糖尿病性神经痛 (diabetic neuropathic pain,DNP) 是由糖尿病性神经病变 (diabetic neuropathy) 引发且临床最为常见的一类神经病理性疼痛,发生在大约30%的糖尿病患者中,严重影响着患者的身心健康和生活质量。DNP的发病机制不清且缺乏有效治疗手段,急需阐明其发病机制并探索新的治疗靶标。G蛋白偶联受体(GPCR)是一类七次跨膜蛋白超家族,广泛参与包括痛觉在内的生理和病理过程。FDA批准的药物中有1/3靶向GPCR,使GPCR成为寻找新治疗靶标的潜在候选目标。
2022年4月6日,浙江大学医学院脑科学与脑医学学院徐贞仲课题组联合浙江大学基础医学院生物物理学系杨帆课题组在国际知名期刊Science Translational Medicine上发表题为“GPR177 in A-fiber sensory neurons drives diabetic neuropathic pain via WNT-mediated TRPV1 activation”的研究论文。该研究揭示了初级感觉神经元中孤儿G蛋白偶联受体GPR177通过WNT5a介导的TRPV1离子通道激活来驱动糖尿病性神经痛发生的分子细胞机制。
孤儿GPCR是一类功能和内源性配体尚不清楚的GPCR受体。该研究发现孤儿受体GPR177在背根神经节(dorsal root ganglion, DRG)中选择性表达于大直径的A类DRG初级感觉神经元中,是促进DNP发生的关键分子。GPR177能够介导WNT5a蛋白从A类DRG神经元分泌至脑脊液中;敲除DRG中的Gpr177可以阻断WNT5a蛋白的分泌,阻止DNP的发生;敲除DRG中的Wnt5a或者用中和抗体拮抗WNT5a分泌蛋白的功能,也可阻止DNP的发生。进一步研究发现,WNT5a能直接激活异源表达的TRPV1离子通道,诱发快速内向电流和单通道活动;并以TRPV1依赖的方式选择性地激活小直径的C类DRG伤害性感觉神经元,引起神经病理性疼痛样表型。基于TRPV1通道三维结构,通过计算机模拟与蛋白对接实验,研究人员发现,WNT5a与TRPV1胞外S5-S6环上的氨基酸残基存在多个潜在结合位点。进一步针对二者的相互作用位点设计了拮抗肽,用于阻断WNT5a对TRPV1的结合和激活。在体实验表明,拮抗肽能有效抑制WNT5a和糖尿病诱导的病理性疼痛。该研究还发现GPR177和WNT5A共同表达在人DRG神经元中,并且临床糖尿病性神经痛患者的疼痛程度与其脑脊液中WNT5A的分泌水平正相关。
综上所述,这项研究揭示了GPR177-WNT5a-TRPV1信号轴是驱动糖尿病性神经痛发病的关键机制(如下图所示),而且WNT5a是TRPV1通道的内源性激动剂,通过干扰WNT5a/TRPV1相互作用可缓解DNP,从而为临床治疗相关神经痛提供了新的治疗靶标和干预策略。
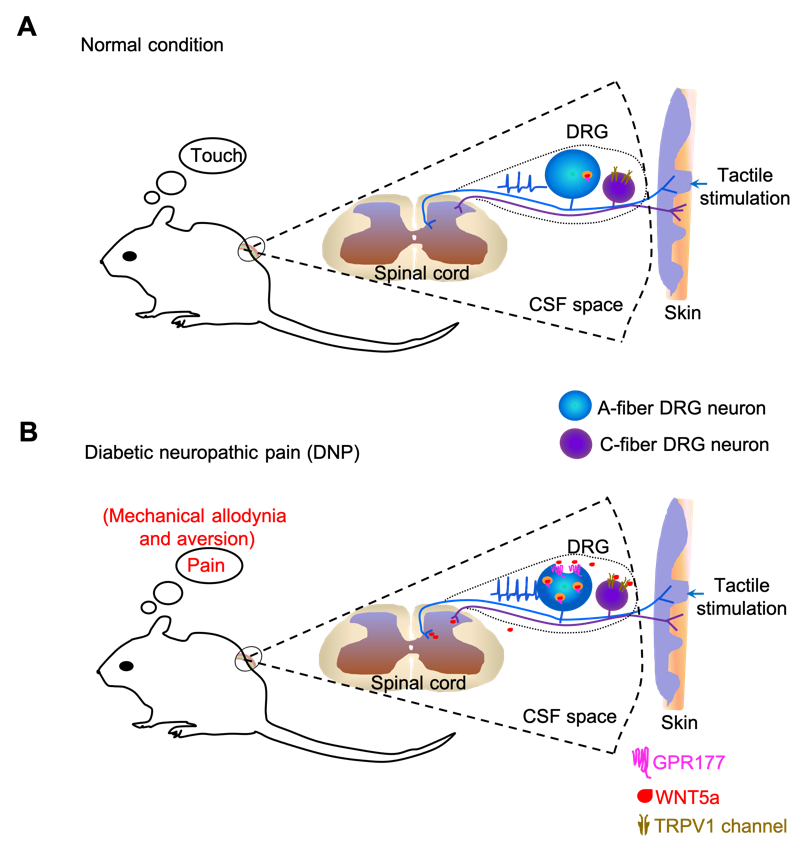
(GPR177-WNT5a-TRPV1信号轴驱动DNP发生的模式图)
浙江大学脑科学与脑医学学院徐贞仲研究员与浙江大学基础医学院生物物理学系杨帆研究员是本论文的共同通讯作者;浙江大学脑科学与脑医学学院谢亚凯、罗浩、张善信和浙江大学基础医学院陈晓莹是共同第一作者。该研究工作得到了浙江大学医学院段树民院士、沈承勇研究员,浙江省人民医院郭然博士,复旦大学脑科学研究院韩清见研究员的大力支持。该研究主要受国家自然科学基金委、浙江省自然科学基金委、科技部、教育部双脑中心等资助。
原文链接:https://www.science.org/doi/10.1126/scitranslmed.abh2557
实验室简介
徐贞仲课题组主要研究疼痛等感觉信号及其可塑性的细胞分子与环路机制,并致力于探索新的药物靶标以及慢性痛的干预策略。主要研究成果发表在Science Translational Medicine (2022), Nature Medicine (2015), Neuron (2014), Journal of Clinical Investigation (2018), Advanced Science (2021), Brain (2021) 等知名学术期刊上。课题组目前在分子生物学、电生理等方向招聘博士后,有意者请联系:xuzz@zju.edu.cn);实验室详细信息请见:https://person.zju.edu.cn/xuzz。






 您的位置 :
您的位置 : 

