2018年6月11日,NatureCommunications在线发表了浙江大学医学院神经科学中心邱爽教授课题组题为Postsynaptic RIM1 modulates synaptic function by facilitating membrane delivery of recycling NMDARs in hippocampal neurons的研究论文。该研究揭示了骨架蛋白RIM1参与调节突触后NMDA受体运输,并进而调控突触可塑性及小鼠学习记忆功能的分子机制(图1)。
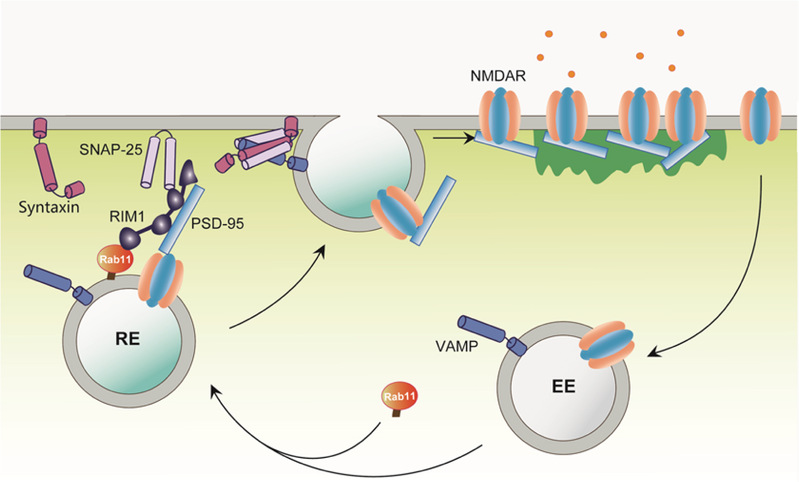
图1. RIM1参与调控NMDA受体再循环途径的模式图
NMDA受体是关键的记忆分子,突触上的数量受到精确调控,但是NMDA受体如何插入或者撤离突触一直是个谜。邱爽教授课题组在研究中发现,参与突触前囊泡释放的核心分子 RIM1不仅定位于小鼠海马的突触前,在突触后部位也有分布。通过在海马CA1区注射病毒并结合脑片电生理及行为学检测,他们分析了突触后RIM1敲减对突触功能及小鼠学习行为的影响。研究发现,突触后RIM1特异性参与调节NMDA受体介导的突触传递以及NMDA受体依赖的长时程增强(LTP),并进而影响海马相关的学习记忆功能(图2)。随后,利用生化及成像技术,他们进一步发现,RIM1可以作为Rab11的效应因子,参与NMDA受体在突触部位的再循环过程,从而调节膜表面NMDA受体的表达量,进而调控NMDA受体的功能。
该研究首次证实,以往被认为只在突触前定位并发挥重要功能的骨架蛋白RIM1,在突触后部位也有分布,并且特异性参与调控NMDA受体的再循环。该研究也进一步提示,突触后受体囊泡可能与突触前神经递质囊泡共享相似的运输机制,这对于我们寻找干预突触后受体功能靶点提供新的思路。该研究的共同第一作者是王洁洁博士和吕心游博士,共同通讯作者是浙江大学神经科学研究所的邱爽教授,罗建红教授和空军军医大学的陈涛教授。
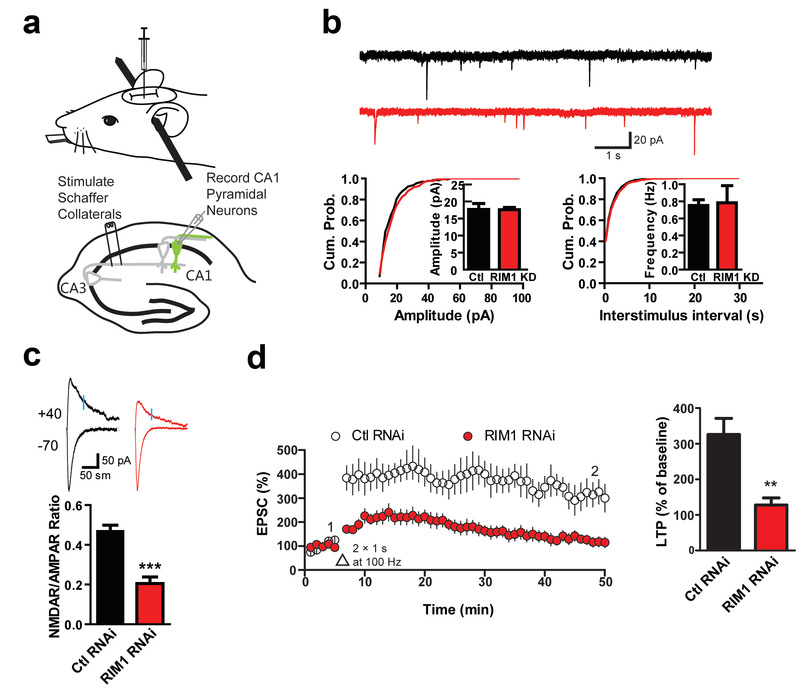
图2. 小鼠海马CA1区RIM1敲减影响NMDA受体介导的突触传递及突触可塑性






 您的位置 :
您的位置 : 

