研究方向包括:1. 神经网络的结构和功能解析(读脑):开发先进的显微成像等手段研究神经网络间的信息通信及调控机制、透明脑技术及三维成像等;2. 基于光遗传学的神经环路功能调控(控脑)。
研究课题获得国家自然科学基金面上项目,国家科技部973项目、国家自然科学基金重大仪器项目、浙江省自然科学基金等资助。主要研究成果已申请或授权专利37个(发明专利24个,实用新型专利13个),并发表在PNAS, Journal of Biophotonics, Optics letters, Optics Express, Applied Physics letters等国际著名期刊上。
本实验室是医工信交叉实验室,“源于技术,高于技术”,旨在用最先进的技术,更简单直接地解决生命科学问题,并最终有效应用于临床医学中,做真正有益于人类健康、服务于社会的事情。
依托自主研发的先进显微成像及光学操控技术研究生物学问题:
b. 光遗传学
c. 基于超分辨技术的DNA的损伤及修复机制的研究;
d. 基于荧光的早期癌症诊断;
现有的,但绝不仅仅只有的几种技术(神经科学成像技术也讲究“快(大视场、实时)”“准(精准到单个神经元以下)”“狠(活体非侵入、大穿透深度)”):
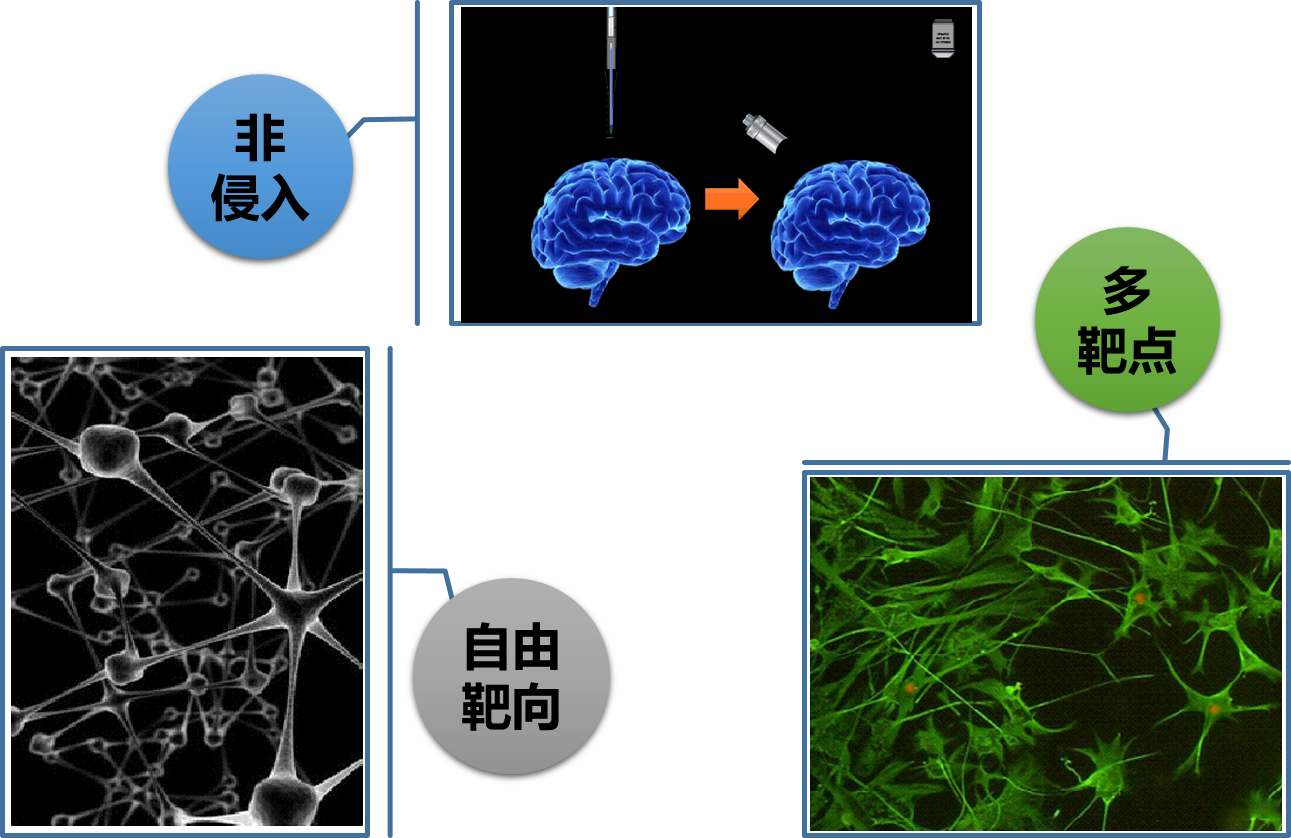
1. 精准神经元调控
非侵入:克服传统光遗传学技术中侵入式光纤植入带来的组织损伤,采用深穿透光聚焦手段,发展非侵入式光遗传学技术。
自由靶向:可以自由选取目标区域进行刺激,克服传统光遗传学光纤损伤性插入后不再能移动位置等不足。
多靶点:可同时/顺序刺激多个目标区域,研究多个目标靶区之间的联系。
2. 活体大深度显微成像
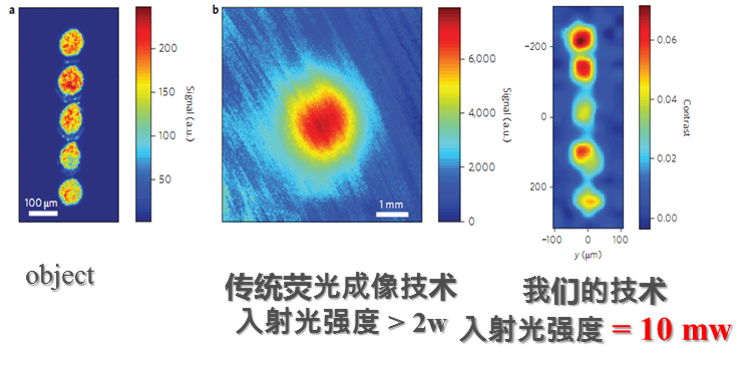
光学显微成像受到组织内部散射和吸收等影响,通常成像深度非常有限,这也是为什么我们在使用共聚焦显微镜时成像深度通常限制在200um左右,即使采用双光子显微镜,成像深度也非常有限。
因此,如何做到在诸如脑皮层这样的强散射生物介质中,实现全脑皮层(1-2mm厚)活体显微成像具有非常重要的意义。
3. 高分辨活体显微成像
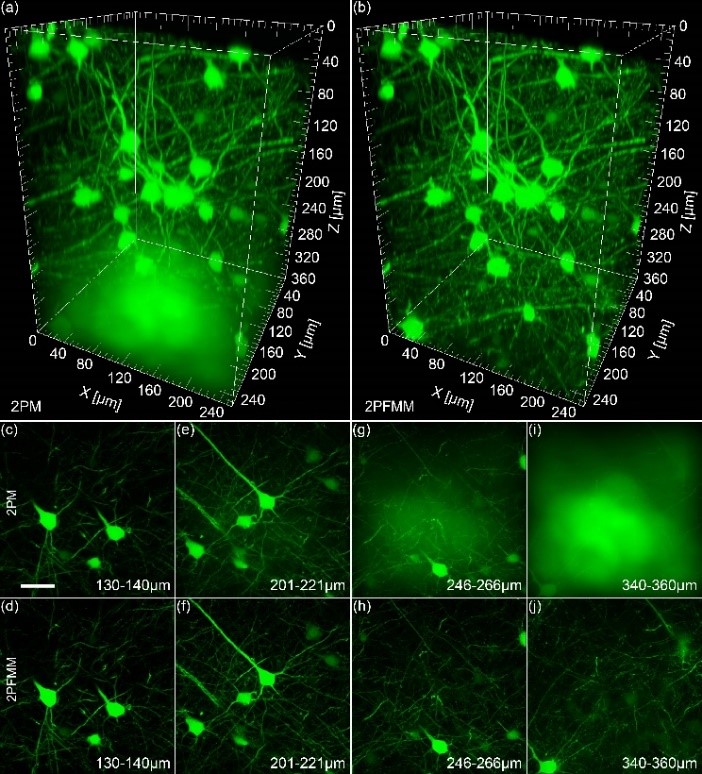
共聚焦显微成像是生物医学中常用的显微成像工具,因为其具备成像分辨率高等特点。但是,在成像深度逐渐增加的情况下,共聚焦显微镜的成像质量会大幅度下降。
因此,如何提高共聚焦显微镜在较深处的成像分辨率,具有显著的实际意义。这里我们采用的是通信原理中调制与解调的原理,最终提高了成像分辨率和信噪比。

4. 实时快速深层成像
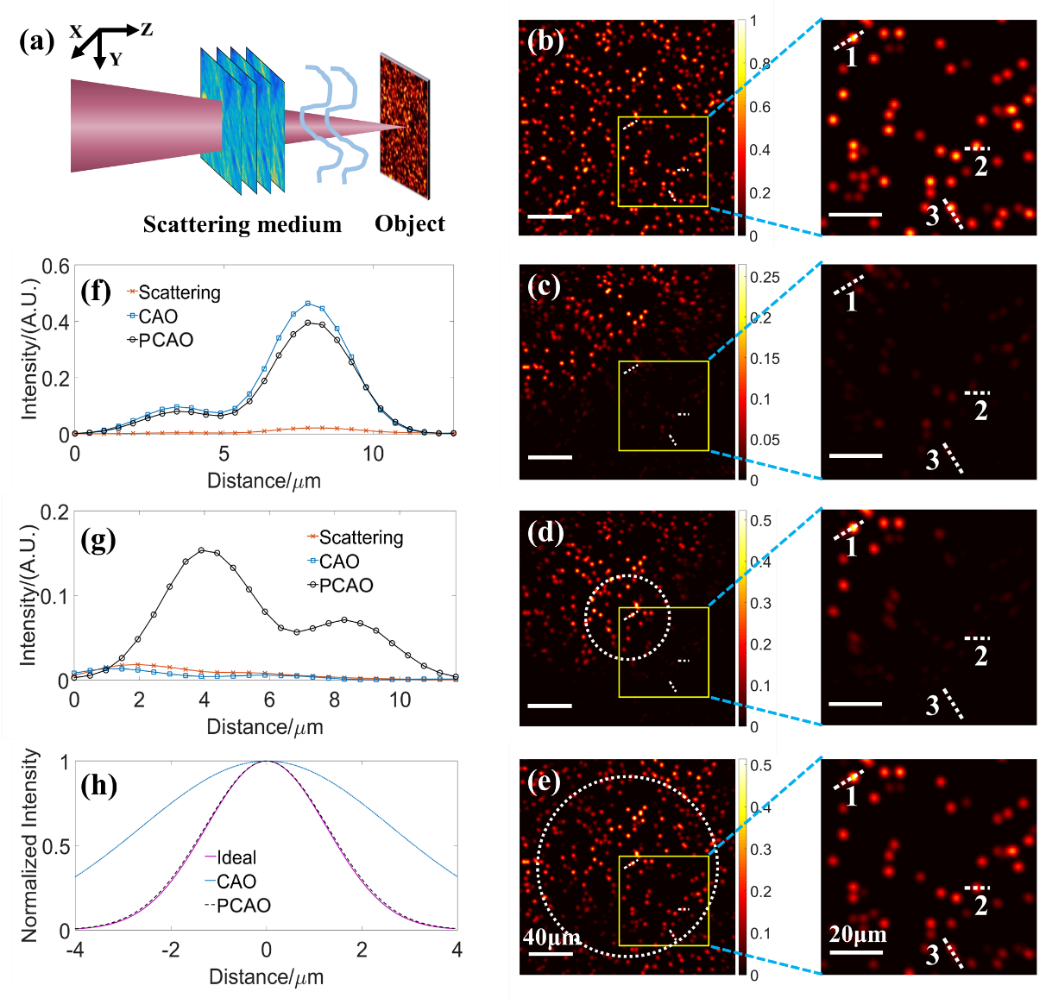
在实际成像时,成像速度受到设备采样速率、刷新率,大深度成像时矫正算法迭代、矫正范围小等影响,成像速度非常慢,并已成为影响成像质量的关键因素。
因此,提高成像速度也是深层成像的一个重要方向。
5. 超快速光清除技术
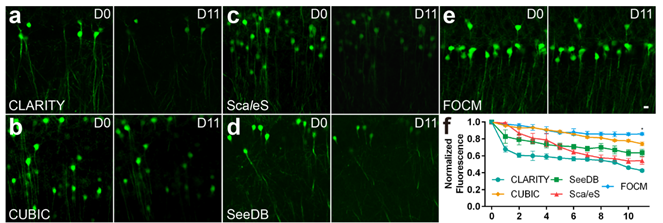
开发了一种具有自主知识产权的快速高效、使用简易、无毒无害、无组织形变、荧光保留持久的光学清除技术,研究成果发表在PNAS上并被高度评价和广泛关注,被F1000推荐。







 您的位置 :
您的位置 : 

